Química - Íons
Para um átomo ser eletricamente neutro ele precisa ter a mesma quantidade de prótons e elétrons, mas como nem sempre isso ocorre, surge então os compostos denominados de íons. Íons são átomos que perderam ou ganharam elétrons em razão de reações, eles se classificam em ânions e cátions:
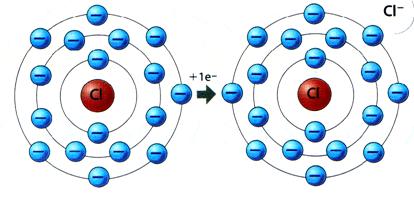
Ânion: átomo que recebe elétrons e fica carregado negativamente.
Exemplos: N-3, Cl-, F-1, O-2.
Cátion: átomo que perde elétrons e adquire carga positiva.
Exemplos: Al+3, Na+, Mg+2, Pb+4.
Quando ocorrem ligações entre íons positivos e negativos denominamos de Ligações Iônicas.
Um exemplo prático de ligação iônica é a que ocorre na formação de Cloreto de sódio, o nosso sal de cozinha cuja fórmula é NaCl, veja a reação:
Na+ + Cl- → NaCl
Só para relembrar:
Ânions – íons negativos;
Cátions – íons positivos.
Vamos então resolver alguns problemas que envolvem íons e prótons:
Primeiro é preciso destacar que ÂNIONS possuem número de elétrons maior que o número de prótons, e CÁTIONS o contrário: o número de elétrons é menor que o número de prótons.
15P → 15P-3
Átomo neutro recebe 3 elétrons
Observe que o átomo de fósforo (P) possuía Z = 15 (número atômico), mas ele ganhou 3 elétrons e então passou a se apresentar como um Ânion.
12Mg → 12Mg2+
Átomo neutro perde 2 elétrons
O átomo de Magnésio (Mg) possuía Z = 12 (número atômico), como ele perdeu 2 elétrons passou a ser um cátion.
A espécie química Mg2+ é chamada cátion bivalente ou íon bivalente positivo. Outro exemplo deste tipo de nomenclatura é o F-, denominado de ânion monovalente ou íon monovalente negativo.
http://www.brasilescola.com/quimica/ions.htm
Por Líria Alves
Graduada em Química
Equipe Brasil Escola
Equipe Brasil Escola
.jpg)

Comentários
Postar um comentário